�u���K���o�j�d�r���Z���T�[�@Galvanic cell
�b����������
http://www.new-cosmos.co.jp/technology/sensor/galvanic/index.html

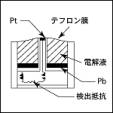
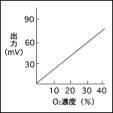
�m �\���} �n
�m �o�͓��� �n
�g�їp��H�Ɨp�̎_�f�Z�x�v�ɓ��ڂ����Z���T�ł��B��舵�����ȒP�ŁA�K�X�̌��o�ɍۂ��ĊO���d����K�v�Ƃ��܂���B
�����m����
2�̓d�ɁiPt-Pb�j�Ɗu����d���t�ō\�����ꂽ�d�r�̔��������Ƃ��Ď_�f�𗘗p�������ɐ����锽���d���𑪒�F�_�f����//�d���B
�n�@�{�@�Q���| �� �@�n�Q�|
�o���@���@�o���Q�{�@�{�@2���|
������
�@ �K�X�̌��o�ɍۂ��ĊO���d����K�v�Ƃ��܂���B
�A ��舵�����e�Ղŕ��y��������܂��B
�B �o�͂��_�f�Z�x�ɔ�Ⴕ�40vol���܂łقڒ����ł��B
����Ȍ��m�ΏۃK�X
�_�f
�����F
�w�d�r�|�_���Ҍ��d�ʁx
�����d����E�H�|�N�}���ɂ̓}���K���d�r��A���J���d�r�A�����Ԃɂ͉��~�d�r�r���v�ɂ͋�d�r��`�E���d�r�E�E �Ȃǂ��@�[�d�d�r�ł̓j�J�h�d�r���悭�g���Ă��܂��B�ŋ߂͗e�ʂ̂���ɑ傫���j�b�P�����f�d�r���r���𗁂тĂ��܂��B�����͂������
�P.�Q�u�Ŋ��d�r�̂P.�T�u���d�����Ⴂ�̂������ł��B�܂����`�E���C�I���d�r�����p������g�ѓd�b��g�уp�\�R���ȂǂɎg����悤�ɂȂ��Ă��܂��B ����͓d�r�Ƃ��̊�ƂȂ�_���Ҍ��d�ʂɂ��Ęb��i�߂čs���܂��B
�u�K���o�j�d�r�v
�g�̎���ɂ͑����̓d�r���g���Ă��܂��B�K���o�j�d�r���Ɏ�� �d�r�̍�p���l���Ă݂܂��B
�C�I�����X����
�j���b�����m�����l�����`�����y�����e�����m�����r�����o�����g2 ���b�����g�����`�����o�����`���@�ƂȂ�
�@�Ⴆ�y���͂b����� �C�I���ɂȂ�₷���Ɗw��ł����Ǝv���܂��B
�Ⴆ�b���r�n4�̗n�t�ɋ����y���̔�Z���ƁA
�@�@�b��2+�@�{�@�y���@���@�b���@�{�@�y��2+�̔������N���蓺���͏o���A�������C�I���ƂȂ��ėn���Ă����킯�ł��B
���̔����́@�y���@�@�@�@�@�@ ���@�y��2+�@�{�Q��-�@�_������
�@�@�@�@�@�@�b��2+�@�{�Q��-�@���@�b���@�@�@�@�@�@ �Ҍ�����
�ɕ����邱�Ƃ��ł��܂��B���̔����œd�q�̈ړ����N�����Ă��܂��B �����ł͓����n�t���œd�q�̎��s���Ă��܂���
-----------�i�u�j---------
Zn*
================
+Cu
| * �@|| | �@�@�@�@�@�@ | || + |
| * �@| �@�@�@�@�@�@ | + |
| * NO3-| �@�@�@�@�@�@|NO3-
+ |
| Zn2+ | �@�@�@�@�@ |Cu2+ |
�@�@ �P�P�P�P�P�P
�P�P�P�P�P�P
Zn���������͈����d�Ɂ@�b���{�{�{�{���d�Ɂ@�������������͉���
�����Ƃ͗Ⴆ�Ί��V��[���`�����P�O���j�m�n3�ŖO�a���Ĕ��Ō`�ɂ������̂ł��B�i���ۂ��̉����œd�r�����Ƃ����ɂ��߂ɂȂ�܂��j ��}�̂悤�ȑ��u��g�ݗ��Ă�Ɠd�q��---(V)---��ʂ��Ĉړ����܂��B���́{�Ɂi�J�\�|�h�j�A�����́|�Ɂi�A�m�|�h�j�ƂȂ�܂��B
�d�r�̓C�I�����X���̈Ⴂ�𗘗p���������ȉ��w�������u�Ƃ����܂��B �y���m�n3�Ƃb���m�n3/�̔Z�x���Pmol/l�̂Ƃ��i�u�j�̓d���v�͂P.�P�u�������܂��B
���̂悤�ɓd�r�͂b���Ƃy���̊Ԃ̃C�I���ɂȂ�Ղ��̍��𗘗p���� �d�C�����o���Ă��܂��B
��̓d�r�����ŕ\����
�@�i�|�j�@�@�y���b�y��2+�i�P�l�j�a�b��2+�i�P�l�j�b�b���@�i�{�j
�ƕ\���܂��B�a�͉�����\���Ă��܂��B ���̑��͎_������鑤�̔��d�r�A�E���͊Ҍ�����鑤�̔��d�r��\���Ă��܂��B
�u�_���Ҍ��d�ʁv
��قǂ̃K���o�j�d�r�𑪒肷��ƂP.�P�u�̓d����������Ɛ������܂���������͂ǂ̗l�ɂȂ��Ă���̂ł��傤���H ���͓�����d�ʂ͂������ł͂Ȃ��A�m�y��2+�n��m�b��2+�n�ɂ��ω����Ă���̂ł��B
���̓d�ʁi�N�d�́j�d�� �d���d���|(RT/nF)ln([Zn2+]/[Cu2+])�ƕ\�����̂ł��B
�܂��Q�T���ł� �d���d���|(0.05913/2)�������i�m�y��2+�n�^�m�b��2+�n�j�B
���̎��̓l�����X�g�̎��ƌĂ�A�q�F8.3145 �i�j-1 mol-1
�e�F96485 �b mol-1�A�s�F���x�i�j�j�ł��B�����Q
�d�K�͕W���N�d�͂Ƃ����@�m�y��2+�n���m�b��2+�n���Pmol/l
�̏ꍇ�̋N�d�͂ł��B ���f���C�I�����X�����傫���������_�ŗn������Ɛ��f���o�Ă���悤�ɁA�C�I�����X���͐��f�i�g2�j���P�̊�ɂȂ��Ă��܂��B�����ň����ƈ����d�ɂɁA���f��O�a�������_�n�t�ɔ����d�ɂ�Z�������d�r��t�����d�r���l���܂�(�W�����f�d��)�B�C�I�����X����舟�����|�ɁA�����d�ɂ��{�ɂ�
�@�@�@�y���b�y��2+�a�g+�i�Pmol/l�j�b�o���C�g2�i�P�C���j
�Ȃ�܂��B�����d�ɂ̓d�ʂ��O�u�ƌ��߂�ƁA���肳���d�r�̓d�ʂ� �����|�����C�I���̓d�ʂƂȂ�܂��B
���l�ɁA�g2�C�o���b�g+�i�Pmol/l�j�a�b��2+�i�Pmol/l�j�b�b���@�̓d�r���l���A�d�ʂ𑪒肷��Ƃb���|�b��2+�̓d�ʂ����肳��邱�ƂƂȂ�܂��B�����̔��d�r�̓d�ɓd�ʂ�W���d�ɓd�ʂƂ��ł��܂��B
�@�@�@�@�@�@�@�@�@�@�W���d�ɓd�ʁ^�u�C�Q�T��
�k��+�^�k�� �|�R.�O�S�T �j+�^�j �|�Q.�X�Q�T
�b��2+�^�b�� �|�Q.�W�U�U �m��+�^�m�� �|�Q.�V�P�S
�y��2+�^�y�� �|�O.�V�U�R �e��2+�^�e�� �|�O.�S�S�O
�b��2+�^�b�� �|�O.�S�O�R �o��2+�^�o�� �|�O.�P�Q�U
�Q�g+�^�g2 �O �@ �@
�b��2+�^�b�� �{�O.�R�R�V �`��+�^�`�� �{�O.�V�X�X
�n�g-�^�n2 �{�O.�S�O�P �h-�^�h2
�{�O.�T�R�T
�g��2+�^�g�� �{�O.�V�X�Q �a��-�^�a��2 �{�P.�O�V�T
�b��-�^�b��2 �{�P.�R�T�X �e-�^�e2 �{�Q.�U�T
��قǂ̓d�r�ł͂y��2+�^�y���@ �|�O.�V�U�R�u
�b��2+�^�b���@ �{�O.�R�R�V�u�̒l���o�Ă��܂��B
�d�r�̕W���d�ʂ͂d���͉E���̊Ҍ��̕W���d�ɓd�ʂd������
~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~
�����̎_���̕W���d�ɓd�ʂd���������������œ�����̂�
~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~
�O.�R�R�V�u�|�i�|�O.�V�U�R�u�j���P.�P�u�ƂȂ�킯�ł��B